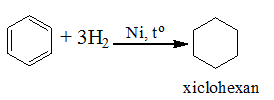Bài 1 trang 172 SGK Hóa học 11. So sánh tính chất hóa học của: a) anken với ankin b) ankan với ankylbenzen
So sánh tính chất hóa học của:
a) anken với ankin b) ankan với ankylbenzen.
Cho thí dụ minh họa.
a) So sánh tính chất hóa học anken và ankin:
Giống: anken và ankin đều có liên kết bội trong phân tử nên đều tham gia phản ứng cộng và bị oxi hóa bởi KMnO4
Vd: Cộng hiđro: (xt, Ni)
CH≡CH + 2H2 CH3 ─ CH3
CH2=CH2 + H2 CH3 ─ CH3
- Cộng brom (dung dịch).
CH2=CH2 +Br2→CH2Br-CH2Br
CH≡CH + 2Br2 → CHBr2─CHBr2
- Cộng HX theo quy tắc Mac-côp-nhi-côp (Cộng H vào nguyên tử cacbon có nhiều hidro hơn)
CH2=CH2 + HCl →CH3-CH2Cl
CH≡CH + HCl CHCl = CH2
CHCl = CH2 +HCl CHCl2─CH3
- Làm mất màu dung dịch KMnO4.
H2C=CH2 + KMnO4 + 4H2O → HOCH2-CH2OH + MnO2 + KOH
CH≡CH + KMnO4 + H2O → HOOC-COOH + MnO2 + KOH
Khác: do ankin có liên kết 3, còn anken chỉ có liên kết đôi
- Anken : Không có phản ứng thế bằng ion kim loại.
- Ankin : Ank-1-in có phản ứng thế bằng ion kim loại.
CH≡CH + 2AgNO3 + 2 NH3 → AgC≡CAg ↓vàng + 2 NH4NO3
b) So sánh ankan và ankylbenzen
Giống: đều có phản ứng thế H
- Phản ứng thế với halogen:
CH4 + Cl2 →(a/s) CH3Cl + HCl
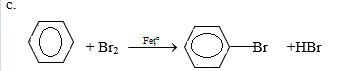
Khác nhau: do ankylbenzen có vòng thơm nên có thể tham gia các phản ứng cộng và thế H trong vòng
- Ankylbenzen: phản ứng thế H trong vòng thơm
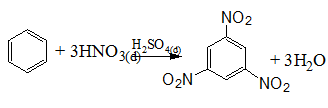
- Thế HNO3/H2SO4:
- Ankylbenzen: cộng H2